抑郁症背后的微生物密码:肠道菌群或成抗抑郁药物疗效的关键


该研究的初衷是探索肠道菌群在抗抑郁药疗效中所扮演的角色和发挥的作用。为此,安定医院团队收集了110个重度抑郁症患者使用艾司西酞普兰(escitalopram,ESC)前后3个时间点的血液和粪便样本:基线、用药后2周和12周,对血液样本做非靶向代谢组检测,对粪便样本做宏基因组测序和非靶向代谢组检测(图1)。以HAMD-17(汉密顿抑郁量表-17)作为抑郁症严重程度的评分,将12周HAMD-17低于/等于7作为缓解组(Remitters,R),大于7则为非缓解组(Non-Remitters,NR)。这项研究还用了160个健康个体的样本作为健康参照,最后用于分析的总样本数量有460个,产生的宏基因组测序数据4.86T。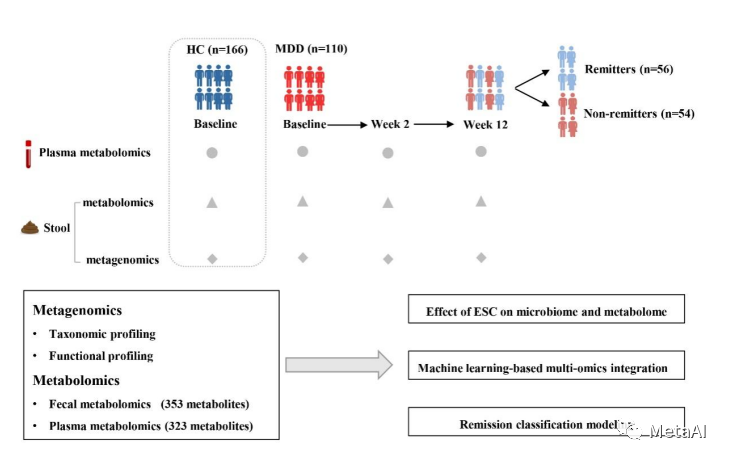 图1. 研究设计概述
图1. 研究设计概述
1.抗抑郁药(ESC)能够改善血液代谢
为了阐明ESC对血液和粪便代谢以及肠道微生物的影响,我们首先在纵向上对这3个组学数据进行分析。我们先用PERMANOVA做了纵向的组成变化,发现血液代谢从基线到12周有显著变化。由于该研究是一项观察性研究,并没有对很多影响代谢或者微生物群的因素进行严格控制,因此,我们采用了线性混合效应模型(Linear Mixed Model,LMM)进行纵向分析,纳入了年龄、性别、BMI,抑郁持续时间和访视周等多个因素作为固定效应,个体作为随机效应。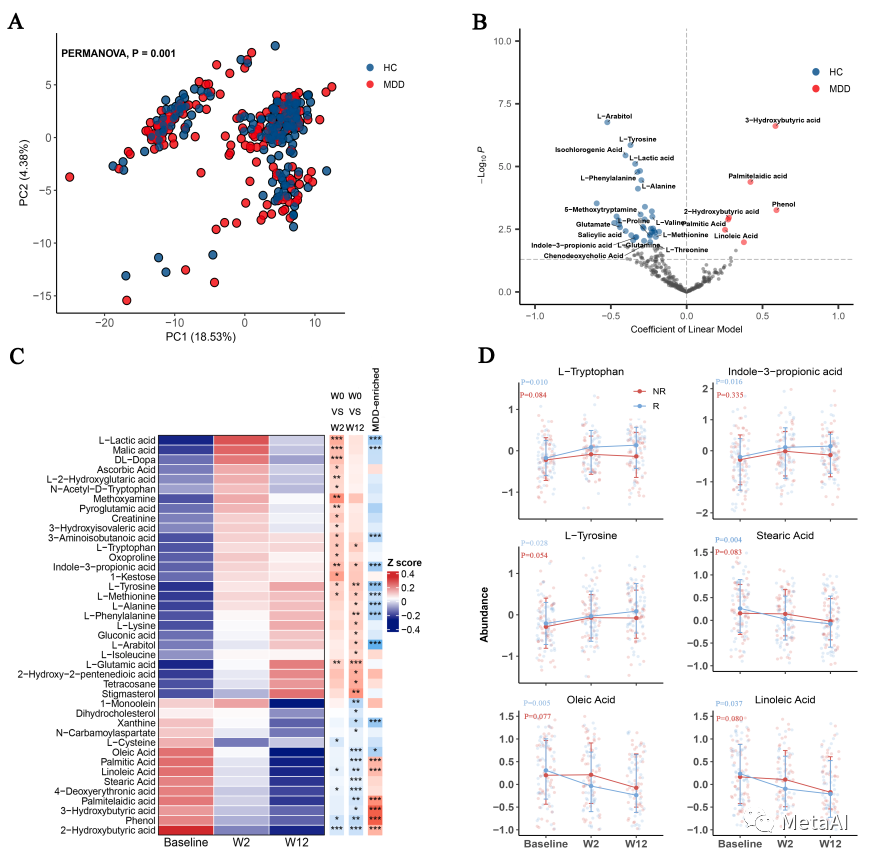 图2. MDD患者血浆代谢组失调以及ESC治疗对血浆代谢物的影响
图2. MDD患者血浆代谢组失调以及ESC治疗对血浆代谢物的影响
在血液代谢层面上,我们先观察到了HAMD-17评分与血液代谢的主成分分析中的PC3(主成分3)是相关的,这表明血液代谢变化与抑郁症相关。在具体的代谢物变化上,我们观察到了氨基酸代谢物上升,一些脂肪酸下降(图2C)。这些上升的氨基酸或者下降的脂肪酸本身是抑郁症的潜在生物标记物。值得着重提的代谢物是色氨酸(L-tryptophan)以及它的代谢衍生物3-吲哚丙酸(indole-3-propionic acid,I3PA)。色氨酸是5-羟色胺(5-hydroxytryptamine,5-HT)的前体,而I3PA是色氨酸的肠道微生物代谢衍生物。这两种代谢物在ESC使用后都有所上升。I3PA是一种有益代谢物,在免疫、神经生成和修复上都发挥了作用。更重要的是,如果将样本分成缓解组(R)和非缓解组(NR)进行分析,这两种代谢物只在缓解组上升。这些结果让我们进一步相信肠道微生物在ESC疗效中发挥作用。
2.抗抑郁药副作用:表现出抑菌效应
与血液代谢不同,对肠道微生物的纵向分析结果显示,ESC对肠道菌群的作用表现出类似抗生素的抑菌效应。首先,整体上看,无论是物种多样性还是基因多样性在药物使用后都显著下降(图3A)。在具体微生物物种上,我们没有观察到类似血液代谢物的情况,即抑郁症相关细菌下降或者健康相关的细菌上升。反而观察到大多数微生物代谢途径丰度下降。 图3. ESC治疗对肠道微生物群的影响
图3. ESC治疗对肠道微生物群的影响
不过,我们发现被ESC影响的细菌物种很多都是产孢子细菌(spore-forming bacteria),也因此我们把关注点转移到孢子基因上,对孢子基因的分析结果显示,ESC使用后这些基因的丰度显著下降。但如果分成缓解组(R)和未缓解组(NR)来看,无论是多样性的下降,还是微生物功能,以及孢子基因丰度下降都主要发生在NR组(图3A,E)。从上述的结果中,我们推测R组相对与NR组对ESC抑菌效应具有更好的抵抗能力。我们从抗生素基因的角度去分析,结果也显示了整体上抗生素相关基因在ESC干预后上升,但从统计角度上并没有那么明显。所有我们认为孢子生成机制在对ESC抑菌效应上发挥了重要的作用。
3.肠道微生物可以影响具体的血液代谢物
血液代谢物与肠道微生物之间的关系已经有很多研究成果。在我们这项研究中,我们用LASSO模型,构建了血液代谢物与肠道微生物之间的关系。我们发现这两者的关系在抑郁症群体和健康人之间存在明显不同,抑郁症群体中血液代谢物的变异能够更多地被肠道菌群所解释(图4C)。这在一定程度上说明了抑郁症群体中肠道微生物影响着血液代谢物。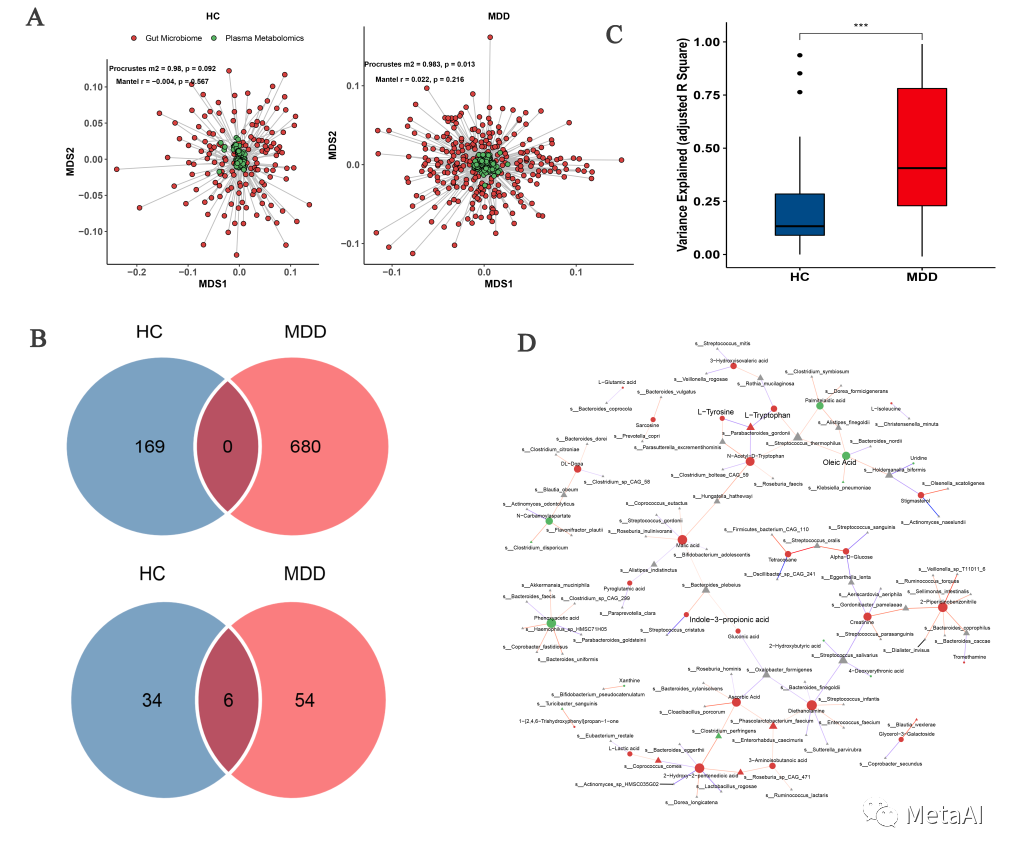 图4. 血液代谢组和肠道微生物组的关联整合
图4. 血液代谢组和肠道微生物组的关联整合
使用纵向上所有的抑郁症样本这两个组学的数据,我们用GLMMLasso的方法关联血液代谢物与肠道微生物,我们发现很多被ESC影响的血液代谢物能够与肠道微生物联系起来,包括上面提到过的色氨酸和I3PA(图4C)。并且I3PA与肠道微生物多样性存在显著的正相关。这些结果说明ESC改变的血液代谢物是与肠道微生物相关的,肠道微生物可以通过参与影响血液代谢物进而影响ESC疗效。
4.良好的肠道菌群状态有助于抑郁症状缓解
这项研究的另外一个主要目的探索肠道微生物是否可以作为ESC用药能否缓解抑郁症状的标记物。为此,我们分析基线中缓解组(R)和未缓解组(NR)之间微生物菌群的差异。尽管微生物组成在两组上无差异,但R组的物种多样性显著高于NR组(图5A, B)。因为物种多样性与本身对外界干扰的抵抗力密切相关,我们通过网络分析,发现R组的菌群网络比NR组具有更好的鲁棒性,也就是能够更好地抵抗外界影响。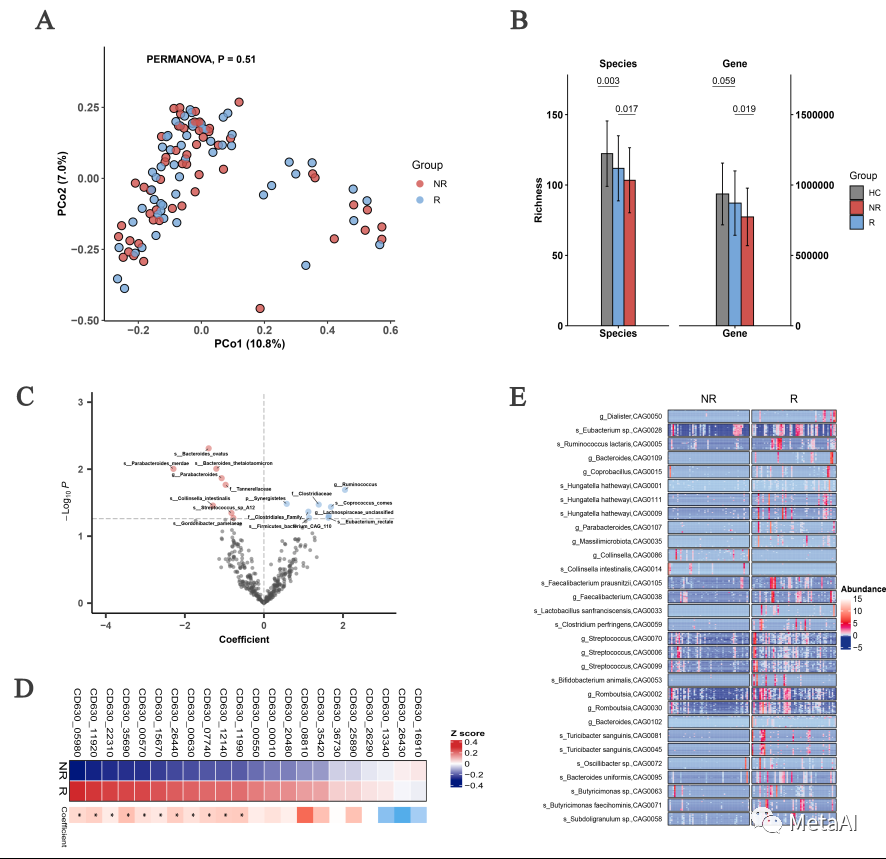 图5. 缓解组(R)和未缓解组(NR)在基线上组间的菌群差异
图5. 缓解组(R)和未缓解组(NR)在基线上组间的菌群差异
另外,与产孢子相关的基因也是R组要显著高于NR组(图5D)。R和NR组的菌群差异并没有那么多,为此,我们在基因水平构建了CAGs(Co-Abundance Groups),基于CAGs两组差异结果显示R组比NR组存在更多的有益菌或者产丁酸菌,比如普拉梭菌(Faecaecalibacterium prausnitzii),乳状瘤胃球菌(Ruminococcus lactaris),直肠真杆菌(Eubacterium rectale)等。直肠真杆菌在3个时间点基本都是R组要高。这些结果显示了在基线,缓解组的肠道菌群状态,不论是多样性还是具体细菌,都要好于未缓解组。
5.基线孢子基因可以用以预测抗抑郁药疗效
进一步我们通过构建机器学习分类模型来评估肠道微生物作为ESC用药缓解的表现。我们用分类群、多样性、孢子基因以及孢子基因丰度变化程度等多种特征用随机森林来构建分类模型。为了尽量保证分类模型能够反应这些特征的分类能力,我们用Nested Cross Validation来评估模型。结果显示,孢子基因所构建的分类模型性能最佳,平均AUC能够达到0.736。虽然不算优秀,但依然反应的肠道微生物的产孢子机制在ESC用药缓解中发挥的作用。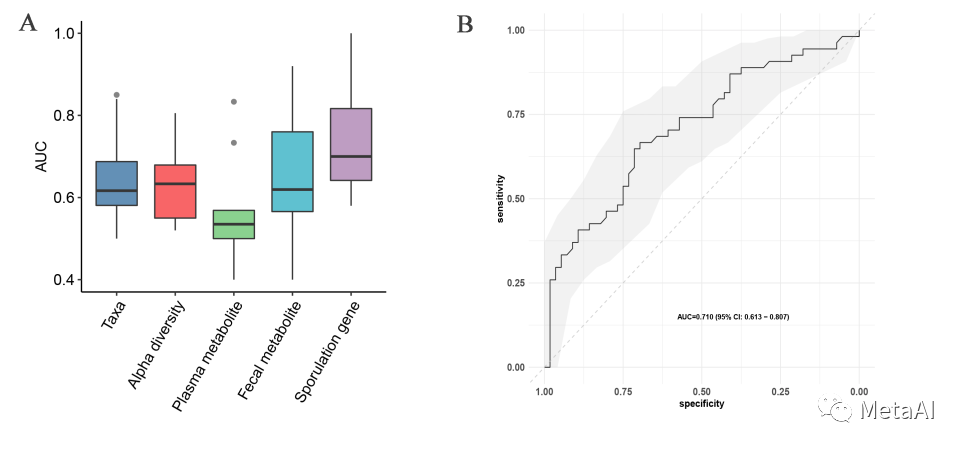 图6. 机器学习分类预测模型性能
图6. 机器学习分类预测模型性能
总得来说,通过这项研究,我们可以描绘会一个抗抑郁药通过肠道微生物影响药物疗效的可能途径:抗抑郁药并没有通过改善肠道菌群来影响药物疗效,相反,抗抑郁药具有一定的类似抗生素的抑菌效应,这可以认为是抗抑郁药的副作用。但不同的抑郁症个体肠道菌群不同,有些个体因为具有较好的菌群状态,以及更多的产孢子菌,能够抵抗这种副作用。而一个良好菌群能够为抗抑郁药发挥疗效提供支持,比如生成一些具有神经生成和修复作用的I3PA等物质。这些发现在理解抗抑郁药物、肠道微生物和血液代谢之间错综复杂关系方面具有重要意义。有助于更广泛地理解抑郁症治疗的复杂机制,并为优化治疗方法开辟了新的途径。
微基范式致力于打造基于数据及AI驱动的健康平台,目前为客户提供微生物组检测以及生物信息数据解决方案。
座机
021-58390070
发送您的留言
微信扫码咨询

